Hoofdstuk 1
Atomen bestaan uit:
- Protonen, zijn positief geladen deeltjes, weergeven met de letter p.
- Neutronen, zijn ongeladen deeltjes, weergeven met de letter n.
- Elektronen, zijn negatief geladen deeltjes, weergeven met de letter e-.
De onderzoeker Rutherford ging het atoom verder onderzoeken. Hij kwam erachter op welke plaats de protonen, elektronen en neutronen zich in het atoom bevinden. Ook ontdekte hij uit hoeveel protonen een bepaalt atoom bestaat.
De protonen en neutronen bevinden zich dicht bij elkaar in de atoomkern. De elektronen vormen een wolk aan de buitenkant van het atoom. Tussen de atoomkern en de wolk is een lege ruimte, er bevindt zich hier helemaal niets.
Atoomnummer = aantal protonen = aantal elektronen.
Massagetal = aantal protonen + aantal neutronen.
Atoomnummer = de massa van atoomsoorten.
Molecuulmassa = de massa van de moleculen in het atoom.
Ionen zijn deeltjes die een positieve of negatieve lading heeft. Ionen trekken elkaar veel sterker aan dan ongeladen elektronen. Stoffen die uit ionen bestaan hebben dus een veel hoger smeltpunt dan stoffen die uit moleculen bestaan.
Een enkelvoudig positief ion is een atoom met een positieve lading. Het atoom heeft dan één of meer elektronen afgestaan.
Een enkelvoudig negatief ion is een atoom met een negatieve lading. Het atoom heeft dan één of meer elektronen opgenomen.
Ionen kunnen ook uit een groepje atomen bestaan. Het groepje atomen heeft dan één of meer elektronen afgestaan of opgenomen. Zulke ionen noemen we samengestelde ionen.
|
Naam: |
Formule: |
|
Zilverion |
Ag+ |
|
Nikkelion |
Ni2+ |
|
Zinkion |
Zn2+ |
|
Chroomion |
Cr3+ |
|
Koper(I)ion |
Cu+ |
|
Koper(II)ion |
Cu2+ |
|
Kwik(I)ion |
Hg+ |
|
Kwik(II)ion |
Hg2+ |
|
Ijzer(II)ion |
Fe2+ |
|
Ijzer(III)ion |
Fe3+ |
|
Tin(II)ion |
Sn2+ |
|
Tin(IV)ion |
Sn3+ |
|
Lood(II)ion |
Pb2+ |
|
Lood(IV)ion |
Pb4+ |
|
Ammoniumion |
NH4+ |
|
Naam: |
Formule: |
|
Hydride-ion |
H- |
|
Fluoride-ion |
F- |
|
Chloride-ion |
Cl- |
|
Bromide-ion |
Br- |
|
Jodide-ion |
I- |
|
Hydroxide-ion |
OH- |
|
Nitrietion |
NO2- |
|
Nitraation |
NO3- |
|
Chloraation |
CiO3- |
|
Acetaation |
CH3COO- |
|
Nietride-ion |
N3- |
|
Waterstofcarbonaation |
HCO3- |
|
Waterstofsulfaation |
HSO4- |
|
Oxide- ion |
O2- |
|
Sulfide-ion |
S2- |
|
Sulfietion |
SO32- |
|
Sulfaation |
SO42- |
|
Carbonaation |
C2O42- |
|
Oxalaation |
PO42- |
|
Fosfaation |
SiO32- |
|
Fosfide-ion |
P3- |
1u = 1,66x10-27 kg.
De massa van zowel protonen als neutronen is 1u.
De massa van de elektronen is zo klein dat je die weg mag laten.
Isotopen = atomen met hetzelfde atoomnummer, maar met een ander massagetal.
Atomen zijn ongeladen deeltjes, ionen zijn geladen deeltjes die positief of negatief kunnen zijn.
Lading wordt uitgedrukt in:
- Coulomb
- Atomaire ladingseenheid.
Het periodiek systeem bestaat uit:
- Perioden (horizontaal)
- Groepen ( verticaal)
Er zijn 4 groepen elementen:
- Alkalimetalen ( 1e groep)
- Aardalkalimetalen (2e groep)
- Halogenen (17e groep)
- Edelgassen (18e groep)
Electovalentie = de lading van een enkelvoudig ion.
Stoffen(massa):
- Moleculaire
Bestaan uit alleen maar niet metalen en geleiden geen stroom.
- Zouten (congehe)
Bestaan uit zowel niet metalen als wel metalen, geleid alleen maar stoom in de fasen l en aq.
- Matalen
Bestaan uit alleen maar wel metalen, geleid alleen maar stroom in de fase s en l.
Ontledingsreacties:
- Fotolyse
- Electrolyse
- Thermolyse
Smelt en kookpunt: smelt en kooktraject:
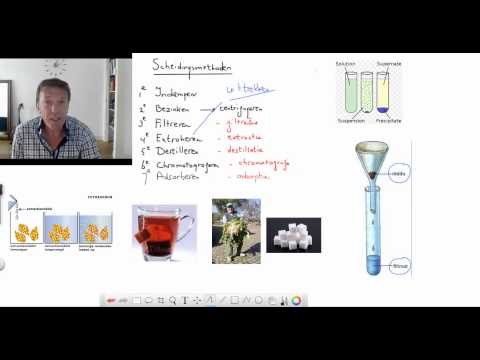
Scheidingsmethodes:
- Filtreren = verschil in deeltjes grote.
- Indampen = verschil in kookpunt en vluchtigheid.
- Chromografie = verschil in oplosbaarheid en aanhechtingsvermogen.
- Bezinken = verschil in dichtheid.
- Adsorptie = verschil in aanhechtingsvermogen.
- Extraheren = verschil in oplosbaarheid.
- Centrifugeren = verschil in dichtheid.
- Destilleren = verschil in kookpunt.
|
Groep |
Lading ion |
|
1 |
1+ |
|
2 |
2+ |
|
13 |
3+ |
|
15 |
3- |
|
16 |
2- |
|
17 |
1- |
1 = mono
2 = di
3 = tri
4 = tetra
5 = penta
6 =hexa
7 =hepta
8 = octa
9 = nona
10 = deca
Hoofdstuk 2
Moleculaire stoffen zijn opgebouwd uit moleculen.
Dat zijn ongeladen deeltjes die bestaan uit atomen. Als al die atomen hetzelfde zijn, dan is de moleculaire sof een element. Als al die atomen verschillend zijn, is de moleculaire stof een verbinding.
Een stof geleid elektrische stroom als:
- Een stof bestaat uit geladen deeltjes, ionen.
- De geladen deeltjes vrij kunnen bewegen.
Moleculaire stoffen zijn altijd ongeladen, ze laten dus nooit stroom door.
|
Naam: |
Formule: |
|
Glucose |
C6H12O6 |
|
Suiker |
C12H22O11 |
|
Kaarsvet |
C18H36O2 |
|
Koolstofmono-oxide |
CO |
|
Koolstofdioxide |
CO2 |
|
Methaan |
CH4 |
|
Water |
H2O |
|
Waterstof |
H2 |
|
Waterstofperoxide |
H2O2 |
|
Waterstofchloride |
HCl |
|
Zwavel |
S8 |
|
Zwaveldioxide |
SO2 |
|
Zwavelzuur |
H2SO4 |
|
Roest |
Fe2O3 |
|
Ammoniak |
NH3 |
|
Ethanol |
C2H6O |
|
Natriumchloride |
NaCl |
|
Calciumcarbonaat |
CaCO3 |
|
Natriumcarbonaat |
Na2CO3 |
Triviale naam = de standard naam.
Systematische naam = met voorvoegsel.
Atoombinding = de bindingen tussen twee atomen. Deze bindingen bestaan uit twee elektronen. Die elektronen noemen we bindingselektronen.
Soms delen beide atomen de elektronen volledig. Dat is bijvoorbeeld bij het getal bij een vinding tussen twee gelijke atomen of tussen een C-atoom en een H-atoom.
Soms zijn de bindingselektronen meer in de buurt van het andere atoom dan is het een polaire atoombinding. Een polaire atoombinding vind je tussen een O-H atoom of een N-H atoom.
Een structuurformule = geeft aan hoe atomen in een molecuul met elkaar verbonden zijn.
Covalentie = het aantal bindingsmogelijkhedenvan een atoom.
Meervoudige binding = als er twee of meer bindingen gevormd moeten worden tussen twee moleculen.
Atoombindingen worden verbroken tijdens een chemische reactie.
Van de Waalsbinding = bindingen tussen de moleculen in de vaste en vloeibare fase. In de gas fase is de afstand tussen de moleculen te groot om een Van der Waalsbinding te vormen.
Hoe zwaarder de moleculen, des te sterker is de Van der Waalsbinding, des te hoger is het kookpunt van een stof.
De Van der Waalsbinding wordt verbroken als de stof verdamp of oplost. Tussen OH en NH bruggen kan ook een waterstofbinding H-brug gevormd worden.
Vb.
O – H ∙ ∙ ∙ O – H ∙ ∙ ∙ O – H
l l l
H H H
OH en NH groepen lossen op in water.
Stoffen die wel oplossen in water zijn hydrofiel.
Stoffen die niet oplossen in water zijn hydrofoob.
Oplosbaarheid van een stof = hoeveelheid gram van de stof maximaal kan oplossen in honderd gram water van een bepaalde temperatuur. Als dit het geval is, is de oplossing verzadigt. Als er nog meer bij kan is de oplossing nog onverzadigd.
de oplosbaarheid van gas wordt kleiner als de temperatuur stijgt.
Hydrofiel en hydrofiel mengen onderling goed.
Hydrofoob en hydrofoob mengen onderling ook goed.
Hydrofiel en hydrofoob mengen onderling niet goed.
Een emulsie is een mengsel van vloeistoffen. De druppeltjes van de ene vloeistof zweven in de andere vloeistof.
Een suspensie is een mengsel van een vaste stof in een vloeistof. Kleine deeltjes van de vaste stof zweven in de vloeistof.
Schuim is een mengsel van een gas in een vloeistof. Belletjes van het gas zweven in de vloeistof.
Nevel is een mengsel van een gas en een vloeistof. Kleine druppeltjes vloeistof zweven in een gas.
Rook is een mengsel van een vaste stof en een gas. Kleine druppeltjes van een vaste stof zweven in een gas.
Hoofdstuk 3
Iets wat je kunt meten, noem je een grootheid.
Achter een grootheid moet altijd een eenheid.
Het internationaal stelsel van eenheden (SI) is de afgesproken eenheid.
Cijfers die een betekenis hebben noem je significante cijfers.
Hoe nauwkeuriger de gemeten waarde, des te groter is dan het aantal significante cijfers.
Met keer en gedeeld door gaat het om het totale aantal significante cijfers.
Met plus en min gaat het om het aantal significante cijfers achter de komma.
Een reactievergelijking is een verkorte weergave van een reactie formule. Zowel links als rechts van een reactie vergelijking moet even veel atomen van elk soort voorkomen.
Een coëfficiënt is bijvoorbeeld: NH3
Index is: 3 NH3
De molmassa, of molaire massa van een stof is hetzelfde als de molecuulmassa of de atoommassa van die stof. Alleen is de molmassa is in gram en de molecuulmassa is in u.
Voorbeeld: C12H22O11 is 342 u
C12H22O11 is dus 342 gram
Voor berekeningen met molverhoudingen heb je nodig:
- De reactie vergelijking
- De gegeven stof, waarbij de hoeveelheid bekend is.
- De gevraagde stof, waarbij je de hoeveelheid moet berekenen.
- De mol verhouding
Een voorbeeld voor heb berekenen met een mol verhouding is:
- 1. Hoeveel gram is 3,0 mol water?
Water = H2O, de molecuulmassa van water = 18,02 u
Gram = mol * molecuulmassa.
3,0 * 18,02 = 54 gram water is dat.
- 2. Hoeveel gram Cu ontstaat uit 2,0 gram CuO?
4 CuO (s) + CH4 (g) = 4 Cu (s) + CO2 (g) + 2 H2O (l)
CuO is de gegeven stof, je hebt er namelijk 2,0 gram van.
CuO = 79,55 u dus ook 79,55 gram
1/79,55*2= 0,025.
2,0 gram CuO is dus 0,025 mol CuO.
Cu is de gevraagde stof.
De molverhouding
Aan de reactievergelijking te zien is de mol verhouding tussen CuO en Cu 4:4. Dat betekend dus dat er even veel mol Cu als CuO ontstaat.
Nu moet je het alleen nog omrekenen naar gram. Cu is 63,55 u is dus ook 63,55 gram.
63,55*0,025= 1,6 gram Cu.
De molariteit van een deeltjessoort is het aantal mol van die deeltjessoort in één liter oplossing. De molariteit wordt weergegeven in mol L-1 of M.
Voor berekeningen met molariteit heb je nodig:
- Het aantal mol van een opgeloste deeltjes soort.
- Het volume van een oplossing in liters.
- Het rekenschema waarin het aantal mol volume staat.
Een voorbeeld voor het berekenen met molariteit is:
- 1. In 5,0 mL bloed van een diabetespatiënt wordt 4,0x10-5 mol glucose aangetroffen. Hoe
groot is de molariteit van de suiker in het bloed van deze patiënt?
5,0 mL = 5,0x10-5 L
Er is 4,0x10-3 mol opgeloste suiker.
|
Mol suiker |
4,0x10-5 |
X |
|
Liter bloed |
5,0x10-3 |
1,0 |
4,0x10-5/5,0x103 = 8,0x10-3 mol
De molariteit van de suiker in het bloed is dus: 8,0x10-3 M
- 2. Hoeveel gram alcohol (c2H6O) heb je nodig om 3,0 liter 0,20 M alcoholoplossing te maken?
0,20 M is dus 0,20 mol in 1 liter. Dus in 3 liter zit dan 0,20 * 3 = 0,60 mol.
De molecuulmassa van alcohol = 46,05 u.
Gram = mol * molecuulmassa.
0,60*46,05= 28 gram.
Voor berekeningen met percentage, promillage of ppm heb je nodig:
- Het volume of de massa van één van de stoffen uit het mengsel.
- Het volume of de massa van het mengsel zelf.
- Het rekenschema.
Percentage: per 100
Promillage: per 1000
Ppm: per 1000000
Voorbeeld voor het rekenen met percentage, promillage en ppm is:
- In 100 gram tonijn zit 2,0 μg vitamine B12. Hoeveel massa ppm vitamine B12 bevat de tonijn?
De gegeven stof uit het mengsel is vitamine B12. Het mengsel is tonijn.
Je moet uitrekenen hoeveel gram vitaminen er in 1,0x106 tonijn zit.
2,0 μg = 2,0x10-6 gram vitamine.
Je hebt 100 gram tonijn.
|
Gram vitamine B12 |
2,0x10-6 |
X |
|
Gram tonijn |
100 |
1,00x106 |
2,0x10-6/1,00x106 = 2,0x10-2 gram.
Tonijn bevat dus 2,0x10-2 massa- ppm vitamine B12
. Wat is de massapercentage C in glucose (C6H12O6)?
Je moet dus uitrekenen hoeveel gram C in 100 gram C6H12O6 zit.
C6H12O6 = 180,16 u C6 = 72,06
72,06/180,16*100% = 39,98 gram C
Het massapercentage C in C6H12O6 is dus 39,98%
Aantal/massa/volume → hoeveelheid A/totale hoeveelheid = percentage/promillage/ppm.
Mac-waarde = maximale aanvaardbare concentratie in 1,0 m3 (Binas 97)
ADI = aanvaardbare dagelijkse inname. Dit verschilt per persoon door de massa.
Omreken voorbeelden:
g/L naar kg/m3
g/L = 1,0x10-3 kg/1,0x103 m3 = 0 het is dus hetzelfde.
Mg/m3 naar μg/mL
Mg/m3 = 1,0x103 μg/1,0x106 mL = 1,0x10-3
Gram/molecuulmassa = mol
Mol X molecuulmassa = gram
Mol/liter = M
Massa/volume = dichtheid
Massa/dichtheid = volume
pH = -log[H+]
[H+] = 10-pH
1 u = 1,66x10-24 gram.
1 mol = 6,02x1023
1 mol u = 1 gram.
Hoofdstuk 4
De kenmerken van zouten zijn:
- Dat zouten stoffen zijn met hoge smeltpunten.
- Dat zouten bestaan uit geladen deeltjes, zowel positieve als negatieve ionen.
- Dat zouten in de vaste fase geen elektrische stroom geleiden. Dit komt omdat de ionen in de vaste fase niet vrij kunnen bewegen.
- Dat zouten in de vloeibare fase wel elektrische stoom geleiden. Dit komt omdat de ionen in een gesmolten zot well vrij kunnen bewegen.
- Dat je zouten kan herkennen aan de formule. Daarin wordt het symbool van een metaal gecombineerd met het symbool van één of meer niet-metalen.
Een zout kan drie dingen doen in met water:
- Het lost op met het water.
- Het lost niet op met water, het zinkt dan naar de bodem.
- Het reageert met water.
Enkele toepassingen van zouten zijn:
- Natriumfluoride
Natriumfluoride is een zout dat bestaat uit natrium-ionen en fluoride-ionen. Fluoride-ionen beschermen je gebit. Daarom bevatten veel merken tandpasta het zout natriumfluoride.
- Kunstmest
Planten halen vooral de atoomsoorten K, P en N uit de bodem. Na enige tijd ontstaat er een tekort aan deze ion soorten. Dat tekort wordt aangevuld door het strooien van kunstmest. De meeste kunstmest bevatten de zouten: kaliumionen, fosfaationen, ammoniumionen en nitraationen.
- Calciumcarbonaat
Calciumcarbonaat is een zout dat bestaat uit calciumionen en carbonaationen. Er bestaan veel verschillende verschijningsvormen van dit zout. Calciumcarbonaat wordt gebruikt voor bijvoorbeeld schoolkrijt.
- Natriumchloride
Natriumchloride bestaat uit natriumionen en chlorideionen. Het wordt uit steenzout gehaald door extractie met water. Het wordt gebruik voor bijvoorbeeld keukenzout.
- Glas
Glas is een mengsel van zouten. De meeste soorten glas bevatten natriumionen, kaliumionen, calciumionen, carbonaationen en silicaationen.
De hoeveelheid van elke ionsoort bepaalt met welk soort glas je te maken hebt. Zachtglas gaat pas smelten bij een temperatuur van ongeveer 700°C. hardglas gaat pas smelten bij een temperatuur van ongeveer 820°C.
Als glas smelt blijven de ionen elkaar nog redelijk stevig vast houden. Het glas blijft dus ook wel redelijk bij elkaar, daardoor is het gemakkelijk allerlei vormpjes te maken.
Om de naam van een zout te weten te willen komen dan moet je eerst de namen weten van de ionen waaruit het zout bestaat. De namen daarvan worden dan aan elkaar gekoppeld. De naam van het positieve ion komt altijd vooraan.
De formule van een zout is een verhoudingsformule. Aan de verhoudingsformule kun je zien in welke verhouding de positieve en negatieve ionen in het zout voorkomen.
Om een samengesteld ion komen geen haakjes als de index 1 is. Als de index groter is dan 1 moeten er wel haakjes omheen. In verhoudingsformules mogen de ladingen van de ionen worden weggelaten.
Zouten zijn opgebouwd uit positieve en negatieve ionen.
Een regelmatige rangschikking van deeltjes noem je een kristalrooster.
Als dat rooster bestaat uit ionen heet het een ionenrooster.
Een ionbinding of elektrovalentie is een binding die optreed in een ionrooster. Deze binding is het gevolg van de elektrische aantrekkingskrachten tussen positieve en negatieve ionen.
Ionbindingen zijn veel sterker dan vanderwaalsbindingen en H-bruggen.
Naarmate de aantrekkingskracht tussen de ionen sterker is, is de ionbinding sterker. Dit komt onder andere tot uiting in hogere smelt en kookpunten.
Water laat geen elektrische energie, dit komt omdat water uit ongeladen moleculen bestaat.
Hydratatie = als de ionen van een zout loslaten als het zout in water oplost, dan dringen de ionen zich tussen de watermoleculen. Elk ion wordt daarbij omgeven door een mantel van watermoleculen.
De opgeloste ionen heten dan gehydrateerde ionen. De water mantel wordt weergeven door achter de formule van het ion (aq) te zetten.
Een voorbeeld van een oplosvergelijking is:
NaCl (s) → Na+ (aq) + Cl- (aq)
Een voorbeeld van een indampvergelijking is:
Na+ (aq) + Cl- (aq) → NaCl (s)
In de oplosbaarheidstabel in Binas 45A kan je vinden of stoffen goed of slecht met elkaar oplossen.
Oplossingen van hydroxiden worden vaak met hun triviale namen aangeduid:
|
Officiële naam |
Triviale naam |
Afkorting |
|
Natriumhydroxide- oplossing |
Natronloog |
Na2O |
|
Kaliumhydroxide- oplossing |
Kaliloog |
K2O |
|
Calciumhydroxide- oplossing |
Kalkwater |
CaO |
|
Bariumhydroxide- oplossing |
Barietwater |
BaO |
In plaats van ‘de molariteit van kaliumionen’ mag je nu [K+] gebruiken.
Die haakjes mag je alleen gebruiken als het gaat om deeltjes die werkelijk in de oplossing aanwezig zijn. Ze mogen dus wel om lossen ionen heen staan, maar niet om de formule van een zout.
Hard water is water dat Ca+- ionen en of Mg2-- ionen bevat. Hoe meer van deze ionen in het water voorkomen, des te harder het water is.
Het ontstaan van hard water:
CuCO3 (s) + H2O (l) + CO2 (aq) → Ca2+ (aq) + 2 HCO- (aq)
H2CO3 = koolzuur
De nadelen aan hard water is:
- Bij het verdampen of verhitten.
Er ontstaat ketelsteen in de waterkoker. Ook komt er eerder kalkaanslag op de verwarmingselementen van de wasmachine en afwasmachine. Ook raken de gaatjes in het stroomstrijkijzer verstopt. Verder krijgen de tegels en kranen in douche en badkamer een witte kalkaanslag.
Ca2+ (aq) + 2 HCO- (aq) → CuCO3 (s) + H2O (l) + CO2 + andere zouten.
Schuimgetal = de hoeveelheid toegevoegde zeepoplossing.
ijklijn = de rechte lijn die het verband aangeeft tussen de molariteit van de Ca2+ - ionen en het schuimgetal.
De letter s van de oplosbaarheidstabel heeft twee betekenissen:
- Als je het zout in water brengt, lost het niet op.
- De ionen van het zout kunnen niet samen in één oplossing voorkomen, als je de ionen wel bij elkaar brengt, reageren ze tot een vaste stof.
Een reactie tussen ionen waarbij een vaste stof ontstaat, heet een neerslagreactie.
De vergelijking die de reactie tussen de ionen weergeeft, heet ionenvergelijking.
Neerslagreacties kun je gebruiken voor:
- Ongewenste ionen uit een oplossing te laten verwijderen.
Dit kan door middel van een ionsoort toevoegen dat slecht oplost met de ionsoort die je wilt verwijderen uit de oplossing. Als je dat hebt gedaan filter je alles en in je residu zit dan het ongewenste ionsoort.
- Nieuwe zouten te maken.
Dit kun je doen door middel van de twee ionsoorten van het zout bij elkaar te mengen, dit wordt dan een zout en vervolgens filtreer je het andere weg.
- Het aantonen van een bepaalde ionsoort in een oplossing.
Dit kan door middel van te kijken in de oplosbaarheidstabel in de Binas en te kijken welke ionsoorten slecht mengen met het ion dat je wilt aantonen. Dan moet je nog wel een oplossing maken met een ander ion dat wel goed mengt met de ionsoorten. Vervolgens doe je dat in de oplossing en als er dan een zout ontstaat dan zit de ionsoort er wel in, is dit niet het geval, dat zit het ionsoort er niet in.
Koper(ll)sulfaat bindt het water chemisch. Het is een vorm van hydratatie. Er ontstaan dan bindingen tussen de watermoleculen en de ionen van het zout. Dat gebonden water wordt kristalwater genoemd. De zouten die de moleculen bevatten, heten zouthydraten.
Toepassingen van zouten die het water kunnen binden:
- Zouten die water kunnen binden, worden als droogmiddel gebruikt.
- Bouwmaterialen zoals gips, cement en beton ontstaan doordat watervrije zouten water binden. Die zijn hard en stevig.
Hoofdstuk 5
Je komt in je omgeving allerlei processen tegen waarbij een warmte-effect optreedt. Voorbeelden van zulke processen zijn oplossingen van stoffen, faseovergangen en chemische reacties.
Een proces waarbij warmte wordt afgestaan aan de omgeving, heet een exotherm proces.
Een proces waarbij warmte wordt opgenomen van de omgeving, heet een endotherm proces.
De reactiesnelheid wordt uitgedrukt in het aantal mol van een bepaalde stof dat per seconde en per liter reactiemengsel verdwijnt of ontstaat. Het symbool voor de reactiesnelheid is s. De eenheid waarin je de reactiesnelheid uitdrukt is: mol per liter per seconde (mol L-1 s-1)
De snelheid van een chemische reactie is van het begin het grootste en neemt dan langzaam af tot 0.
De reactietijd is de tijdsduur van hoelang de reactie duur van begin tot einde.
De snelheid van de reactie hang af van:
- De soort stof.
- De verdelingsgraad van de beginstoffen.
- De concentratie van de beginstoffen.
- De temperatuur van het reactiemengsel.
- De katalysator.
Als stoffen zich verplaatsen van de ene ruimte naar de andere ruimte spreken we niet meer van reactiesnelheid, maar van transportsnelheid. de transportsnelheid blijkt te worden beïnvloed door de concentratie, de verdelingsgraat en de temperatuur.
De reactiesnelheid neemt tie als de concentratie van één van de beginstoffen groter wordt. De reactiesnelheid wordt ongeveer twee keer zo groot als de temperatuur 10 graden hoger wordt.
Een effectieve botsing is een botsing tussen twee deeltjes die tot een reactie lijdt. Hoe meer effectieve botsingen per seconde, des te groter is de reactiesnelheid. Dit heet het botsende-deeltjes-model. Het aantal effectieve botsingen wordt groter als:
- De concentratie vergoot wordt, dus meer deeltjes in een bepaald volume.
- De temperatuur stijgt.
- De verdelingsgraad vergroot wordt, dus als een stof fijner verdeelt is.
Als er zich een chemisch evenwicht instelt, verlopen twee reacties tegelijkertijd in tegenovergestelde richtingen met dezelfde snelheden. In het evenwichtsmengsel bevinden zich zowel beginstoffen als reactieproducten.
In een evenwichtsmengsel is het aantal mol beginstoffen vrijwel nooit gelijk aan het aantal mol reactieproducten. In het evenwichtsmengsel blijft het aantal mol van elke stof hetzelfde.
De concentratiebreuk kan allerlei waarden aannemen. Pas in de evenwichtstoestand is deze waarde constant. deze constante waarde noemen we de evenwichtsconstante, weergeven met de letter K.
De evenwichtsvoorwaarde luidt, de concentratiebreuk = K.
De waarde van K is slechts afhankelijk van de temperatuur. Alle andere factoren hebben geen invloed op de waarde van K.
Voor de concentratie breuk geldt ook wel [B]/[A] = K.
Een voorbeeld hiervan is:
N2O4 (g) → 2 NO2
[NO2]2 / [N2O4] = 0,20
K is dus in dit geval 0,20.
We kunnen van elke evenwichtsreactie een aflopende reactie maken door één van de reagerende stoffen uit het reactiemengsel te verwijderen. Het verwijderen van een stof die rechts van de pijl staat laat de reactie naar rechts aflopen. Voor links geldt natuurlijk hetzelfde.
Een dynamisch evenwicht is als het lijkt alsof er niks gebeurt, maar er toch wel van alles gebeurt. Een voorbeeld hiervan is bij de kassa. Gedurende de dag zal de rij bij de kassa ongeveer even lang blijven, en lijkt het dus alsof er niets gebeurt, echter is dat wel zo, want er staan steeds andere mensen in de rij.
Een statisch evenwicht is als er in het evenwicht helemaal niets meer gebeurt, er is dan ook geen uitwisseling meer. Een voorbeeld hiervan is touwtje trekken.
Hoofdstuk 6
De hoeveelheid zuur of base in een oplossing wordt uitgedrukt in een getal: de pH of de zuurgraad van de oplossing.
Een oplossing is zuur als de pH lager dan 7 is.
Een oplossing is basisch als de pH hoger dan 7 is.
Een oplossing is neutraal als de pH precies 7 is.
Je kunt de pH van een oplossing op een paar manieren meten:
- Met universeelindicatorpapier, dan doe je druppeltjes van de oplossing op een stukje speciaal papier en die verkleurt dan. Vervolgens kun je met de kleur dan aflezen wat de pH ongeveer is.
- Een pH-meter, dit is een elektronisch instrument. Er moet dan een staafje in de oplossing worden gedaan, dit staafje is gevoelig voor H+ ionen en daardoor kan er op een schermpje dat verbonden is met het staafje de pH afgelezen worden.
- De zuur-base-indicator, dit zijn stoffen die in een zure oplossing een andere kleur hebben dan in een basische oplossing of een neutrale oplossing. Het pH gebied waarin een indicator van kleur verandert, noem je het omslagtraject.
In een zure oplossing bevinden zich H+-ionen. Hoe meer van deze ionen er in een oplossing zitten, hoe zuurder de oplossing is.
|
Naam zuur |
Molecuulformule |
|
Waterstofchloride |
HCl |
|
Salpeterzuur |
HNO3 |
|
Zwavelzuur |
H2SO4 |
|
Fosforzuur |
H3PO4 |
|
Koolzuur |
H2CO3 (H2O + CO2) |
|
Azijnzuur |
CH3COOH (HAc) |
Er zijn ook zuren die per molecuul meer dan één H+-ion kunnen vormen. Dat zijn meerwaardige zuren. Zwavelzuur is bijvoorbeeld een tweewaardig zuur.
Zuren die in een aflopende reactie in water reageren, heten sterke zuren. In oplossing van deze zuren zitten geen opgeloste zuurmoleculen. Er zijn alleen maar H+-ionen en zuurrestionen aanwezig.
Zuren die in een evenwichtsreactie in water reageren, heten zwakke zuren. In oplossing van deze zuren zitten opgeloste zuurmoleculen, H+-ionen en zuurrestionen. De opgeloste zuurmoleculen zijn in de meerderheid.
In de formule van een oplossing van een sterk zuur staan H+-ionen en zuurrestionen.
In de formule van een oplossing van een zwak zuur staat alleen het opgeloste zuur.
De pH kan je bereken met de formule: pH=-log[H+]
Andersom kan je de H+ concentratie berekenen met de formule: [H+]= 10-pH
Je moet hierbij wel goed kijken naar de hoeveelheid H+, want bij zwavelzuur bijvoorbeeld moet je het nog maal 2 doen want die heeft 2 H+.
|
Triviale naam |
Systematische naam |
Formule |
|
Zoutzuur |
Waterstofchloride-oplossing |
H+ + Cl- (aq) |
|
Verdunt salpeterzuur |
Salpeterzuuroplossing |
H+ + NO3- (aq) |
|
Verdunt zwavelzuur |
Zwavelzuuroplossing |
2 H+ +SO42- (aq) |
|
Verdunt fosforzuur |
Fosforzuuroplossing |
H3PO4 (aq) |
|
Azijn |
Azijnzuuroplossing |
HAc (aq) |
|
Koolzuurhoudend water |
Koolstofdioxide-oplossing |
H2CO3 (aq) of H2O + CO2 (aq) |
Een basische oplossing bevat OH- -ionen. Deze ionen ontstaan als een base in contact komt met water. Een base is een deeltje dat één of meer H+- ionen kan opnemen.
|
Naam base |
Fomule |
|
Ammoniak |
NH3 |
|
Hydroxide-ion |
OH- |
|
Carbonaation |
CO32- |
|
Oxide-ion |
O2- |
|
Oxide-ion |
HCO3- |
|
Acetaation |
CH3COO- (Ac-) |
Basen waarvan alle deeltjes met water reageren in een aflopende reactie worden sterke basen genoemd. In de oplossing van deze basen is de opgeloste base niet meer aanwezig. Alleen de reactieproducten van de reactie tussen de base en water tref je aan.
Basen waarvan lang niet alle opgeloste deeltjes met water reageren noemen we zwakke basen. In oplossingen van deze basen is de opgeloste base nog wel aanwezig. Ook de reactieproducten van de reactie tussen de base en water tref je aan. In de formule staat echter alleen de base zelf.
pOH = -log[OH-]
voor elke oplossing en ook voor zuiver water geldt bij een temperatuur van 298 K:
pH + pOH = 14,00
tijdens een zuur base reactie neemt een base één of meer H+-ionen op. Deze ionen zijn afkomstig van een zuur of uit een zure oplossing.
Een voorbeeld van een zuur-base reactie is:
NH3 + H+ → NH4+
Hoofdstuk 7
Bij redoxreacties heb je altijd twee halfreacties, één oxidator en één reductor. Die samen vormen de totaalreactie.
Een voorbeeld hiervan is:
6 H+ + 6 e- → 3 H2
2 Al → 2 Al3+ + 6 e-
------------------------------
6 H+ + 2 Al → 3 H2 + 2 Al3+
Een halfreactie geeft de verandering weer van één van de beginstoffen.
In de vergelijking van een halfreactie staan altijd elektronen. In de vergelijking van een totaalreactie staan nooit elektronen.
Oxidator is een deeltje dat elektronen opneemt. Een reductor is een deeltje dat een elektron afstaat.
Een redoxreactie is een reactie waarbij elektronen overdracht optreedt. Daarbij kunnen elementen verwijderen of ontstaan. In veel gevallen verandert de lading van één of meer deeltjes van de beginstof.
Een oxidator reageert alleen met een reductor als deze hoger staat dan de reductor in de binas.
SO42- - ionen reageren alleen als OX, als ze aanwezig zij in geconcentreerd zwavelzuur.
NO3- - ionen reageren alleen als OX, als ze aanwezig zijn in een salpeterzuuroplossing.
In een halfvergelijking die bij geconcentreerd salpeterzuur hoort, ontstaat NO2.
In een halfvergelijking die bij verdund salpeterzuur hoort, ontstaat NO.
Een elektrochemische cel is een ander woord voor een batterij.
In een elektrochemische cel kan een redoxreactie plaatsvinden tussen twee beginstoffen. Die twee beginstoffen kunnen van elkaar gescheiden worden door midden van een poreuze wand.
In een elektrochemische cel stromen de elektronen altijd van de – naar de .
Elke elektrochemische cel bestaat uit:
- Twee halfcellen. In elke halfcel bevinden zich een oxidator en een reductor.
- Een metaaldraad. Die beide halfcellen met elkaar verbindt.
- Een elektrolytoplossing. Die een verbinding vormt tussen de oxidator en de reductor die met elkaar reageren.
In een elektrochemische cel reageert de sterkste oxidator die aanwezig is met de sterkste reductor. De elektronen stormen van de halfcel die de sterkste reductor bevat, via de draad naar de halfcel die de sterkste oxidator bevat.
In een halfcel met de sterkste reductor bevindt zich de negatieve elektrode, in de halfcel die de sterkste oxidator bevat bevind zich de positieve elektrode.
Als redox reacties uitsluitend kunnen verlopen door elektrische energie toe te voegen heet dit proces een elektrolysereactie. Het later reageren van de beginstoffen heet elektrolyseren.
Voor een elektrolyse opstelling zijn nodig:
- Een gelijkspanningsbron
- Twee elektroden.
- Stroomdraden
- Een vat waarin de stof zich bevindt.
De elektroden die je verbindt aan de positieve pool worden positief. Voor negatief geldt hetzelfde.
Tijdens een elektrolysereactie reageren altijd de sterkste oxidator en de sterkste reductor met elkaar.
De oxidator reageert altijd bij de negatieve elektrode, daaruit worden elektronen opgenomen. De reductor reageert altijd bij de positieve elektroden, daaruit worden elektronen afgestaan.
Tijdens de elektrolyse van een chloride oplossing reageren de Cl-ionen bij de positieve elektroden en niet water.
Metalen zijn elementen. Dat zijn stoffen die bestaan uit één atoomsoort. Het zijn geen moleculaire stoffen. Hum bouwstenen zijn atomen. Metalen hebben een aantal gemeenschappelijke eigenschappen:
- Ze hebben hoge smeltpunten
- Ze geleiden elektrische stroom
- Ze lossen niet op in allerlei oplosmiddelen
- Ze zijn gemakkelijk te vervormen.
- Ze mengen in gesmolten toestand. Dat levert een legering, of alliage op.
Metalen geleiden elektrische stroom. Dat kan alleen als er bewegelijke deeltjes in een metaal zitten. Die deeltjes bestaan uit de metaalatomen. Elk metaalatoom laat één of meer elektronen uit zijn elektronenwolk los. Die gaan door het metaal zwerven. Deze elektronen noem je vrije elektronen.
Een kristalrooster heet een metaalrooster.
De krachten tussen de geladen deeltjes is het metaalrooster zijn erg sterk. De metaalbinding die hiervan het gevolg is, is een sterk binding. Het kost veel moeite om deze los te maken. Daarom hebben de meeste metalen een hoog smeltpunt.
Gesmolten metalen kun je onderling mengen. Als het mengsel afkoelt, heb je een legering. Een legering noem je ook wel een alliage. Een legering waarin kwik voorkomt heet een amalgaam.
In de natuur worden slechts enkele metalen zoals goed en zilver, als element gevonden. De meeste metalen komen voor als zout. In deze verbindingen, vaak metaalertsen genoemd, zijn de metalen aanwezig als positieve ion. De metalen kunnen op verschillende manieren uit de ertsen worden gehaald:
- De metaalertsen worden verhit in aanwezigheid van koolstof. Één reactieproduct is het metaal.
- Een oplossing van een metaalzout kan geëlektrolyseerd worden. Uit de metaal ionen ontstaan dan bij de negatieve elektroden het metaal.
- Een gesmolten metaalzout kan geëlektrolyseerd worden. Ook nu ontstaat ui de metaalionen het metaal.
De laatste methode wordt alleen toegepast als beide andere methoden ongeschikt zijn. Dat is het geval bij zeer onedele metalen.
Hoofdstuk 8
Er bestaan heel veel koolstofbindingen, die zijn onderverdeeld in subgroepen. Alle stoffen uit dezelfde subgroep lijken op elkaar wat betreft de molecuulstructuur. Eén van deze subgroepen wordt gevormd door koolwaterstoffen. Koolwaterstoffen zijn verbindingen die uitsluitend bestaan uit koolstof atomen en waterstof atomen. De moleculen van koolwatermoleculen kunnen onvertakt en vertakt zijn. In een onvertakte koolwaterstofmolecuul is elk C-atoom met maximaal twee andere C-atomen verbonden. In een vertakte koolwaterstofmolecuul komt minstens één C-atoom voor dat met drie of vier andere C-atomen verbonden is.
Een verzadigd koolwaterstofmolecuul komt uitsluitend voor tussen enkele atoombindingen tussen de C-atomen. De formule hiervoor is CnH2n+2.
Een onverzadigde koolwaterstofmolecuul komt voor tussen één of meer dubbel atoombindingen tussen C-atomen. De formule hiervoor is CnH2n.
Koolwaterstoffen zijn ook weer onderverdeeld in een aantal groepen. Die heten homologe reeksen. Al deze groepen lijken op elkaar:
- Alkanen
- ze bestaan uit C- en H- atomen
- er bestaan onvertakte en vertakte alkaanmoleculen
- tussen de C-atomen in een alkaanmolecuul komen alleen enkelvoudige bindingen voor. Alkanen zijn altijd verzadigde verbindingen
- de moleculen van verschillende alkanen verschillen alleen in het aantal C-atomen en H-atomen.
- De formule is CnH2n+2.
- Alkenen
- Ze bestaan uit C- en H- atomen.
- Er bestaan onvertakte en vertakte alkeenmoleculen.
- In een alkeenmolecuul komt één dubbele binding voor tussen C- atomen. Alkenen zijn onverzadigde verbindingen.
- De moleculen van verschillende alkenen verschillen alleen in het aantal C- atomen en H- atomen.
- De formule is CnH2n.
Isomeren zijn stoffen met dezelfde molecuulformule maar met verschillende structuurformules.
De namen van onvertakte alkanen:
|
Naam |
Molecuulformule |
Structuurformule |
|
Methaan Ethaan Propaan Butaan Pentaan Hexaan |
CH4 C2H6 C3H8 C4H10 C5H12 C6H14 |
CH4 CH3 - CH3 CH3 - CH2 - CH3 CH3 - CH2 - CH2 - CH3 CH3 - CH2 - CH2 - CH2 - CH3 CH3 -CH2 - CH2 - CH2 - CH2 - CH2 - CH3 |
De namen van vertakte alkanen.
Vertakte alkanen hebben één of meer vertakkingen aan de hoofdketens van C-atomen
CH3 = methyl
CH2 - CH3 = ethyl
De namen van onvertakte alkenen.
Een onvertakte alkeenketen heeft dezelfde naam als onvertakte alkaanketen. De uitgang is nu geen ‘aan’ maar ‘een’.
De namen van vertakte alkenen.
Deze werkt hetzelfde als de naamgeving van de vertakte alkanen. De uitgang nu geen ‘aan’ maar ‘een’.
Atomen die verbindingen een karakteristieke eigenschap geven behoren bij een bepaalde atoom of een bepaalde atoomgroep zo’n atoom of atoomgroep noem je een karakteristieke groep. Hallogeenalkanen zijn alkanen waarin één of meer H-atomen zijn vervangen door halogenen.
|
Formule van de groep |
Naam van de groep |
Voorbeeld koolstofverbindingen |
|
- F |
Fluor- |
CH3 – CH2 – CH2 – F |
|
- Cl |
Chloor- |
CH3 – CH – CH2- CH3 I Cl |
|
- Br |
Broom- |
CH3 – Br |
|
- I |
Jood- |
CH3 – CH – CH2- CH3 I I |
|
O II - C –O – H |
-zuur |
O II CH3 - C –O – H |
|
- O - H |
-ol |
CH3 – CH2 – CH2 – CH2 –O –H |
Een subgroep van de carbonzuren wordt gevormd door een homologe reeks van de alkaanzuren. Een alkaanzuur kun je opvatten als een alkaan waarin een CH3 groep vervangen wordt door een COOH- groep.
Alle koolstof verbindingen waarin de karakteristieke groep met de formule –O – H aanwezig is, behoren tot de groep alcoholen. Een subgroep van de alcoholen wordt gevormd door de homologe reeks van alkanolen. Een alkanol kun je opvatten als een alkaan waarin één H-atoom is vervangen door een – O – H groep.
Tijdens een additiereactie worden twee atomen toegevoegd aan een alkeenmolecuul. De dubbel binding in het alkeen verdwijnt. Op de plaats komen twee halogeenatomen. Bij additie van waterstof aan een alkeen ontstaat een alkaan. Bij additie van water aan een alkeen ontstaat een alkanol.
De aanwezigheid van een onverzadigde verbinding kun je aantonen met behulp van een broomoplossing. De bruine kleur van de broom verdwijnt dan. Dat komt doordat een additiereactie plaats vind tussen broom en de onverzadigde verbinding.
In aanwezigheid van gistcellen wordt glucose omgezet in ethanol en koolstofdioxide, dit proces heet vergisting.
Esters zijn verbindingen die je in het dagelijks leven veel voorkomt. Natuurlijke geur en smaakstoffen , ook wel aroma’s zijn vaak zeer ingewikkelde ester mengsels. Ze zijn vaak duur. Een ester bestaat uit een zuur en een alcohol. De reactie verloopt in aanwezigheid van H+ - ionen als katalysator.
Als een ester wordt ontleed door water noemt je het een hydrolyse reactie.
Als hydrolyse van een ester in het lichaam plaatsvindt, wordt deze reactie gekatalyseerd door enzymen.
Natuurlijke oliën en vetten zijn esters. Per molecuul zijn er drie estergroepen aanwezig. Daarom noem je ze tri- esters. De grondstoffen waaruit ze gemaakt worden zijn glycerol en alkaanzuren met lange koolstofketens. Deze alkaanzuren noem je vetzuren.
Bij olie die gewonnen wordt uit zaden of pitten zoals katoenzaadolie en zonnebloempitolie, levert het uitpersen wat meer problemen op. Tegenwoordig worden deze soorten olie verkregen door extractie met hexaan. Daartoe worden de zaden en pitten eerst geplet of gekneusd. Vervolgens wordt het gemengd met hexaan. De hydrofiele oplossing lost op in het hydrofiele hexaan. Na filtratie en afdamping van hexaan heb je olie in handen. Olijfolie wordt gewonnen uit persen van olijven.
Als een olie of vet langdurig wordt verhit treed hydrolyse op. De ester valt dan uiteen glycerol en één of meer vetzuren.
Een vet is bij kamertemperatuur vast, een olie is vloeibaar. Dat komt doordat in een vetmolecuul voornamelijk verzadigde vetzuren zijn veresterd en in oliemoleculen twee of meer dubbele bindingen, dit zijn meervoudig onverzadigde vetzuren.
Als je water toevoegt aan een dubbele binding, wordt het verschil tussen olie- en vet moleculen op geheven. de vloeibare olie wordt dan een vast vet. Dit heet vetharding. Dit kan alleen verlopen door middel van en katalysator.
Vetharding wordt onder andere toegepast in de margarine-industrie. Margarine bestaat uit onverzadigde vetten, maar is toch een vaste stof.
Hoofdstuk 9
Polymeren zijn moleculaire stoffen waarvan de moleculen heel lang zijn. Stoffen die in levende organismen voorkomen zoals eiwitten en koolhydraten zijn natuurlijke polymeren. Alle kunststoffen zoals plastic en polyesters, behoren tot de synthetische polymeren.
Thermoplasten zijn kunststoffen die zacht of vloeibaar worden bij verwarmen. Door het verwarmen worden de van der Waals bindingen verbroken. De temperatuur waarbij een kunststof zacht wordt noem je het verwarmingspunt.
Thermoharders zijn kunststoffen die niet zacht of vloeibaar worden bij verwarming. Deze thermoharders zijn onderling niet verbonden met van de Waals bindingen, maar met atoombingingen. Als deze thermoharders erg lang verwarmt worden, zullen ze uiteindelijk uiteenvallen en veranderen dus in andere stoffen.
Je kan de eigenschappen van kunststoffen veranderen door andere stoffen toe te voegen:
- Weekmakers
Een stugge stof kan hierdoor soepel worden. De moleculen van deze stof dringen zich tussen de moleculen van de kunststof. De onderlinge afstand tussen de polymeer moleculen wordt dan groter, de samenhang wordt dus kleiner.
- Blaasmiddel
Het kunststof krijgt hierdoor een zeer kleine dichtheid. Dit is een vluchtige stof die tijdens de vorming van plastic verdampt. De dampbellen zorgen voor een kunststof met zeer luchtige celstructuur.
- Kleurstoffen
De kleurstofmoleculen vermengen zich met de moleculen van de kunststoffen. Zo verspreidt de kleurstof zich door de gehele kunststof. De kleur slijt nooit af.
Verwerking van thermoplasten.
Kunststoffen worden meestal gemaakt in de vorm van korrels of poeder. Dit gebeurt in de petrochemische industrie. De verwerkende industrie maakt er dan een eindproduct van. De bassis van het verwerken van thermoplasten is de korrels eerst verwarmen tot ze zeer zacht of vloeibaar zijn. Dan wordt de zachte of vloeibare stof in een mol geperst. Dit heet spuitgieten.
Verwerken van thermoharders.
Je hebt hierbij meestal een hoge druk en een hoge temperatuur nodig.
De grondstoffen waarin de polymeren worden gemaakt heten monomeren. De reactie waarin de monomeermoleculen met elkaar reageren, noem je een polymerisatie reactie. De belangrijkste monomeren zijn etheen, propeen en chlooretheen. Chlooretheen wordt ook wel vinylchloride genoemd.
Etheen is een onverzadigd koolwaterstof.
CH2 = CH2
De polymerisatie hiervan is:
CH2 = CH2 CH2 = CH2 CH2 = CH2 → CH2 - CH2 - CH2 - CH2 - CH2 - CH2
De algemere vergelijking is:
N C2H4 → (C2H4) N
Voor propeen geldt:
CH2 = CH CH2 = CH CH2 = CH → CH2 – CH –CH2 – CH – CH2 – CH
I I I I I I
CH3 CH3 CH3 CH3 CH3 CH3
Eiwitten zijn natuurlijke polymeren. De monomeren waaruit ze ontstaan heten aminozuren. De karakteristieke groep van het eiwitmolecuul heet een peptide binding.
H O
I II
- N – C –
Een eiwit dat in de natuur voorkomt zijn er ongeveer twintig. Ze heten essentiële aminozuren, omdat je lichaam deze zelf niet kan aanmaken.
Eiwitten spelen een belangrijke rol als bouwstof. De eiwitten die deze functie hebben noem je structuureiwitten. Een klein deel van je eiwitten is werkzaam als enzym. Enzymen worden ook wel biokatalysatoren genoemd. Enzymen maken bij een vrij lage temperatuur reactie mogelijk die anders niet zouden verlopen.
Koolhydraten zijn stoffen waarvan de moleculen uitsluitend uit C- en H- atomen bestaan. Koolhydraten noem je ook wel sachariden.
Zetmeel is één van de belangrijkste voedingsstoffen. Zetmeel is een polymeer dat ontstaat uit het monomeer glucose. Zetmeel is als reservevoedsel opgeslagen in alle planten. Zetmeel reageert tijdens de reactie met water, uiteindelijk ontstaat er dan glucose. Een deel van het glucose molecuul reageert tot het polymeer glycogeen. Dit wordt opgeslagen in de lever en in het spierweefsel.
Cellulose is een koolhydraat dat het meest voorkomst op de aarde het is een bouwstof voor planten. Mensen kunnen cellulose niet afbreken.
Fotosynthese: 6 CO2 + 6 H2O → C6H12O6 + O2
Suiker kan door extractie met water uit de fijngemalen bieten of riet worden gehaald.
Eiwitten komen voor in voedsel zoals vlees, soja en peulvruchten. Eiwitten worden in je spijsvertering gehydrolyseerd. Daarbij ontstaan aminozuren. Daaruit haalt je lichaam nieuwe eiwitten of enzymen. Enzymen zijn nodig om allerlei reactie in je lichaam bij 37 graden te laten verlopen.
Vetten zitten in bijvoorbeeld boter of margarine. In je spijsvertering worden vetten gehydrolyseerd tot vetzuren en glycerol. Vetzuren worden gebruikt voor de bouw van de lichaamscellen. Onverzadigde vetzuren zijn essentiële vetzuren omdat je lichaam deze zelf niet aan kan maken.
Koolhydraten krijg je binnen via bijvoorbeeld brood. Ze worden in de spijsvertering gehydrolyseerd en daarbij ontstaat voornamelijk glucose. Dit zorgt voor energie in je lichaam.
Mineralen spelen een belangrijke rol in de stofwisseling. Het zijn onmisbare atomen: kobalt, calcium, ijzer, zwavel, fosforkalium, natrium, jood, fluor en seleen. Atoomsoorten waarvan je slechts een zeek kleine hoeveelheid nodig hebt heten sporenelementen.
Vitamines zijn koolstofverbindingen die in kleine hoeveelheden onmisbaar zijn voor je gezondheid.
Hoofdstuk 10
- Het ontstaan van fossiele brandstoffen
Steenkool, aardolie en aardgas noem je fossiele brandstoffen. Dit zijn hoogstwaarschijnlijk een heleboel opeengestapelde dode organismen die door de jaren heen verteerd zijn. Doordat er een hoge druk op kwam te staan en er een hoge temperatuur was konden hierdoor reacties ontstaan en ontstond er materiaal zoals steenkool, aardolie en aardgas.
Al miljoenen jaren geleden werd door fotosynthese al zonne-energie opgeslagen in planten.
Deze zonne-energie is uiteindelijk vastgelegd in de fossiele brandstof.
- Aardolie: winning en samenstelling .
De winning van aardolie vind onder meer plaats in het Midden-Oosten. Aardolie is een mengsel van zo’n 100 000 stoffen. Aardolie bestaat voor het grootste gedeelte uit alkanen. De samenstelling van aardolie kan van bron tot bron verschillen.
- Verwerken van aardolie
Het mengsel aardolie kan je scheiden door middel van destillatie. Het bedrijf waar de destillatiekolommen staan, heten olieraffinaderij. Het destilleren van olie vindt plaats in grote destillatiekolommen. Tijdens de destillatie wordt de aardolie niet gescheiden is afzonderlijke stoffen, maar in mengsels van stoffen. De kookpunten van die stoffen liggen dicht bij elkaar. Zo’n mengsel heet een aardoliefractie. Een aardoliefractie geeft geen kookpunt maar een kooktraject.
- Verwerking van de naftafractie.
Uit de naftafractie kan weer benzine worden gemaakt. Bij een hoge temperatuur en een hoge druk worden onder meer onvertakte alkanen omgezet in vertakte alkanen. Deze verwerking heet reformeren.
- Kraken van de naftafractie.
De grondstoffen voor kunststoffen zoals polyetheen en polypropeen, zijn de alkenen etheen en propeen. Deze kleine alkeenmoleculen worden geproduceerd uit de naftafractie. Dit gebeurt in een naftakraker. Dit is een installatie waarin grotere alkaanmoleculen worden gesplitst in kleinere alkaan en alkeenmoleculen.
Een voorbeeld van een kraakreactie is:
C10H22 → C8H18 + C2H4
het hoogovenproces:
- Productie van ruw ijzer
IJzer wordt gemaakt uit ijzererts =. Dit bestaat uit ijzer(III)oxide. Ijzer is het meest gebruikte metaal. De productie van ijzer uit ijzererts is een grote tak van de chemische industrie.
De installatie waarin ijzer wordt gemaakt uit ijzererts, heet hoogoven. De hoogoven is afwisselend volgestort met lagen koolstof en ijzererts. De temperatuur verschilt tussen de 220 *C tot 1900 *C. Eerst wordt ijzererts en koolstof omgezet in ijzer en koolstofdioxide. Dit ijzer is vloeibaar en zakt naar beneden. Dit mengt met de koolstofdioxide. Dit mengsel heet ruw ijzer. Het koolstofdioxide wordt er voor het grootste gedeelte uit verwijderd. Nu heet deze stof staal.
- Bereiding van staal uit ruw ijzer.
In een groot vuurvast reactievat wordt een baal schroot toegevoegd aan het ruwe ijzer.
- Het schroot reageert met de koolstof die in het ruwe ijzer aanwezig is.
Schroot + koolstof → koolstofmono-oxide + ijzer.
- De koolstof die daarna nog aanwezig is, wordt met zuurstof verwijderd.
Koolstof + zuurstof → koolstofmono-oxide.
Hoe meer zuurstof er door het ruwe ijzer wordt geblazen, blijft er minder koolstof achter en zo ontstaat er meer staal. Dit staal kun je uitwalsen tot platen. Zeer dunne taalplaten heten blik. Vaak wordt er aan staal nog andere elementen toegevoegd, zoals nikkel en chroom om de staal beter geschikt te maken voor bepaalde dingen.
Hoe een fabriek van binnen werkt kun je schematisch weergeven in een blokschema.
Een blok stelt één onderdeel voor van het totale proces:
- Opslag van de grondstoffen.
- Voorbewerking van de grondstoffen, zodat ze gemakkelijk reageren tot het gewenste product.
- De reactie waarin het gewenste product wordt gemaakt.
- Scheiding van het reactiemengsel in het gewenste product en andere stoffen. Die andere stoffen kunnen niet omgezette beginstoffen zijn. Het kunnen ook stoffen zijn die tijdens de reactie als bijproducten zijn ontstaan.
- Opslag van het product.
- Verwerking van de ongewenste bijproducten dot onschadelijk afval.
De pijlen stellen de aan- en afvoer van de verschillende stoffen voor.
Meestal is het rendement niet honderd procent, dit wil zeggen dat niet alle beginstoffen worden omgezet in reactieproducten. In dit geval wordt de niet omgezette beginstof weer teruggevoerd naar het reactievat.
De energie die we in Nederland gebruiken is bijna helemaal afkomstig van fossiele brandstof, de helft wordt geleverd door steenkool en aardolie en de andere helft door aardgas.
De warmte die vrijkomt wordt voor verschillende doeleinden gebruikt:
- Verwarmen van gebouwen met behulp van hete lucht of warm water.
- Heetwatervoorzieningen en directe verwarming.
- Opwekken van bewegingsenergie in verbrandingsmotoren.
- Opwekken van elektrische energie in elektriciteitscentrales.
Fossiele brandstoffen bevatten koolstof en waterstof. Als ze worden verbrand ontstaat er koolstofdioxide en water. Bij een onvolledige verbranding ontstaat er koolstofmono-oxide, roet en onvertakte koolwaterstoffen. Fossiele brandstoffen zijn vaak verontreinigt met zwavelverbindingen. Als deze verbindingen verbranden ontstaat er zwaveldioxide. Bij de verbranding wordt ook een stikstofoxide gevormd. Dit komt doordat er door de hitte zuurstof en stikstof uit de lucht met elkaar reageren.
Zwaveldioxide en stikstofoxiden leveren een grote bijdrage aan de verzuring van het milieu. Deze verzuring kun je verminderen door:
- Terugdringing van het energieverbruik
- Voor de verbranding de zwavel en zwavelverbindingen uit brandstoffen te halen
- Door het ontstane zwaveldioxide uit de verbrandingsgassen te halen voordat ze uit de schoorsteen komen. Dit heet rookgasontzwaveling.
De dampkring is van nature opgebouwd uit een mengsel van gassen waaronder: koolstofdioxide, methaan en ozon. Deze gassen zijn van nature in een bepaalde verhouding aanwezig. Deze gaslaag ligt als een beschermende deken om de aarde heen. Het zorgt ervoor dat de aarde niet te veel warmte verliest. Dit heet het broeikaseffect. Door alle gassen die in de dampkring komen wordt het evenwicht verstoord. De dampkring houd dan te veel warmte vast. Er ontstaat nu dus een toename van het broeikaseffect.
Cfk-gassen leveren ook een bijdrage aan het toenemen van het broeikaseffect. Deze stoffen zijn door mensen in de dampkring gekomen.
Herkomst van de broeikasgassen:
- Koolstofdioxide ontstaat bij de verbranding van fossiele brandstoffen en ander organisch materiaal. Doordat de industrie zich ontwikkeld stijgt de toename CO2 in de dampkring. Tijdens de fotosynthese wordt de CO2 opgenomen. Echter worden er steeds meer tropische regenwouden gekapt, hierdoor steeg te toename nog meer.
- Methaan is het op één na belangrijkste broeikasgas. Het ontstaat onder meer doordat organisch materiaal afgesloten van de lucht ontleedt. Doordat de bevolking toeneemt, is er steeds meer landbouw nodig en dus meer methaan uitstoot.
- Ozon ontstaat door allerlei industriële activiteiten en door de toename van het gemotoriseerde verkeer.
- Cfk-gassen worden door de chemische industrie geproduceerd. Deze gassen zijn aanwezig als koelmiddel in koelkaseten en vrieskasten.
- Distikstofoxide komt vrij als bijproduct bij de verbranding van fossiele brandstoffen. Verder vormen de landbouw en de verbranding van biomassa bronnen van N2O-uitstoot.
Het belangrijkste effect van de toename van het broeikaseffect is een stijging van de gemiddelde temperatuur op de aarde. Hierdoor smelt het poolijs waardoor de zeespiegel omhoog gaat en dus grote stukken land kan overspoelen. Ook kan door de hoge temperatuur de woestijngebieden toenemen. Om dit effect zo klein mogelijk te houden moet men:
- De CO2 uitstoot terugdringen, door vermindering van energie verbruik.
- Ontwikkelen van veilige, duurzame energiebronnen.
- Terugdringen van het autogebruik.
- Ontwikkeling van milieuvriendelijkere landbouwmethoden.
- Terugdringen van de hoeveelheid dierlijke mest.
- Bescherming van de bestaande bossen en herbebossing
- Stoppen van de productie ckf-gassen
De voorraad van de fossiele brandstof raak op, daardoor hoed het ECN (Energieonderzoek Centrum Nederland) zich bezig met het onderzoeken naar duurzame energie. Dit is energie uit een bron die nooit opraakt, zoals zon, wind, water en biomassa.
Zonne-energie is energie die afkomstig is van de zon en via zonlicht op de aarde wordt opgevangen.
Er bestaat een systeem waarbij zonlicht direct wordt omgezet in elektriciteit. Dit gebeurt door middel van zonnecellen. Deze vorm van energie heet photovoltaïsche zonne-energie, ook wel PV.
Daarnaast bestaat er een systeem waarbij zonnestraling wordt gebruikt om water of lucht te verwarmen. Deze vorm van energie wordt thermische zonne-energie genoemd.
Wind is vooral geschikt om elektrische energie op te wekken met windturbines. De elektrische energie wordt direct geleverd aan het elektriciteitsnet.
Als het materiaal dat afkomstig is uit planten en bomen noem je biomassa. Planten en bomen zijn door fotosynthese is staat net koolstofdioxide te binden. De energie die hiervoor nodig is is de zon. Om biomassa om te zetten zijn er verschillende processen mogelijk:
- Vergisting
Hierbij zorgen micro-organismen voor productie van biogas. Dit is een mengsel van methaan en koolstofdioxide. Dit das is geschikt voor verbranding in gasmotoren.
- Verbranding
De warmte die vrijkomt bij de verbranding van de biomassa, wordt via stoomturbines gebruikt om elektriciteit op te wekken.
- Pyrolyse
Als biomassa wordt verhit zonder zuurstof, ontleed het, hierbij ontstaat houtskool, olie en gas.
- Vergassen
De biomassa wordt met kleide hoeveelheden lucht in contact gebracht. Hierbij ontstaat stookgas, een mengsel van koolstofmono-oxide en waterstof. Het stookgas kan worden gebruikt als brandstof in gasmotoren en gasturbines waarmee je elektriciteit kunt opwekken.










REACTIES
1 seconde geleden
E.
E.
NICE!
10 jaar geleden
AntwoordenL.
L.
Wow... dankjewel. Ik zou makkelijk €10,- kunnen neerleggen voor deze samenvatting. Echt fking nice~ <3
9 jaar geleden
AntwoordenN.
N.
staan veel spelfouten in.
9 jaar geleden
AntwoordenR.
R.
Er staan veel slordigheden en onjuistheden in. Onjuist: Atoomnummer = de massa van atoomsoorten. Moet zijn: aantal protonen. 'Afkortingen' van oplossingen van hydroxides zijn fout! Natriumhydroxide is niet Na2O maar NaOH. Daarnaast is het woord 'afkorting' onjuist. Tip: Kijk in je leerboek en niet op deze site.
9 jaar geleden
AntwoordenT.
T.
Geweldig! Prachtig samengevat, dit helpt mijn tentamenstress aanzienlijk te verminderen :)
8 jaar geleden
AntwoordenP.
P.
Spelfouten. Jammer dit
8 jaar geleden
AntwoordenS.
S.
Erg jammer dat ik zoveel spelfouten moet aantreffen in dit document.
8 jaar geleden
AntwoordenM.
M.
Jij denkt even netjes te kunnen gaan praten, grappig!
8 jaar geleden
S.
S.
Wat een gezeur om de spelfouten zeg, het is een goeie samenvatting en haalt heel duidelijke de belangrijkste punten naar boven!!! ?
8 jaar geleden
AntwoordenI.
I.
Als docent scheikunde kan ik alleen maar zeggen: *gebruik deze samenvatting absoluut NIET*. Hij staat boordevol met grove fouten. Het is echt om te huilen zo zo slecht.
6 jaar geleden
Antwoorden